转载自微信公众号:体能网
日期:2020-9-1
概述
灵活性训练在竞技体育中得到了广泛和全面的应用。本文通过考虑机械力和解释身体如何响应机械力并与其相互作用来挑战这种方法的有效性。解释了力学术语以及它们所代表的力如何作用于身体。本文将探讨机械力如何塑造、形成和影响人体,从而构成灵活性。在这种力学灵活性语境中,建议更具体地使用利用机械力和适应性反应的灵活性方式。
引言
灵活性已经成为了一种广泛流行的训练干预对象,然而尽管如此,针对传统灵活性形式的慢性影响的研究还很缺乏;(93)此外,现有的证据经常相互矛盾且多为关于急性影响的信息。(4,8,13,52,60,95)关于灵活性的主张通常认为,运动功能障碍、疼痛、损伤和运动表现都能通过提高和训练灵活性来改善。(95)目前对于这些现存的说法缺乏证据和共识,并且慢性影响的程度也不能驳倒这些主张。
因此,现在运动表现的训练计划经常包括为运动员设计的标准化灵活性训练。但是,从业者和运动员经常应用灵活性的最大意图是利用目前广泛流传的说法。这些说法创造了关于灵活性的神话:绝对有效,没有缺点。
然而,这个神话并未考虑身体的力学机制和适应过程。本文将会探索这些要素,以及灵活性在运动表现训练中的作用。关注点将放在结缔组织及其力学、适应和灵活性增加上。肌肉改变对于灵活性的影响机制尚不明确,但是有力的证据表明,位置感的变化,对于肌肉生理和性能没有长期改变。(93)这就留下了本文希望解决的一个问题——关于结缔组织在灵活性适应中的作用。在解决这一问题时,本文还陈述了灵活性的限制因素,并说明了灵活性训练干预的易错性和代价。
定义力学术语
灵活性训练的代价常常被忽略:通常被视为一种没有缺点的训练干预,从而鼓励了普遍的最大化和不分青红皂白的追求。但是,当理解和应用了力学术语之后,你就会明显发现,如果不改变其特性和周围的支配力,身体的变化就不会发生。
以下是对于相关力学术语的简单描述:
应力(Stress):指施加在单位面积或既定横截面区域中的力。应力是所施加力的内部分布。
应变(Strain):应力的结果,指发生的变形程度。
张力(Tension):源自拉丁语单词“拉伸(to stretch)”。张力是指施加的拉力,可见于拉伸条件下。
刚度(Stiffness):材料抵抗弹性变形的能力。也指应力与应变的比值:刚度是材料的应力/应变曲线的斜率。
柔度(Compliance):柔韧且易于扭曲的性质,是刚度的倒数。当高刚度的材料经历高应力和低应变时,柔性材料会表现出低应力和高应变。这可以通过钢铁(高刚度)和橡胶(高柔度)来进行概念化。
弹性极限(Elasticity):指在不产生永久变形的前提下施加的应力量。它绝不表示弹性极限发生的应变点,只是达到弹性极限所需的应力。为了强调这一点,钢铁和橡胶可以作为类比。钢铁比橡胶具有更高的弹性极限,因为它有更强的抵抗变形的能力。因此,钢铁需要高得多的力来产生变形,但只有很低的应变能力。
杨氏模量(Young’s Modulus):有时被称为弹性模量,用于测量材料对变形的抵抗能力。是应力/应变曲线在弹性区的斜率。
充分理解应力/应变反应:这需要上述多个元素,并通过弹性区、弹性极限(屈服强度)、塑性区(永久性变形发生的区域)、峰值抗性(抗拉强度),以及终止于断裂点的抗性下降来追踪应力/应变曲线。
在语言中刚度常用来表示范围不足;但是,根据它的真实定义,它是组织的理想行为,既能优化力的传递和表现,又能防止软组织损伤。(16)此外,它与可能的变形或拉伸的程度无关;而是表示引起该变形所需的负载(应力)的量。“刚”实际上是指应变能力的缺乏,这种能力由组织特性所决定。
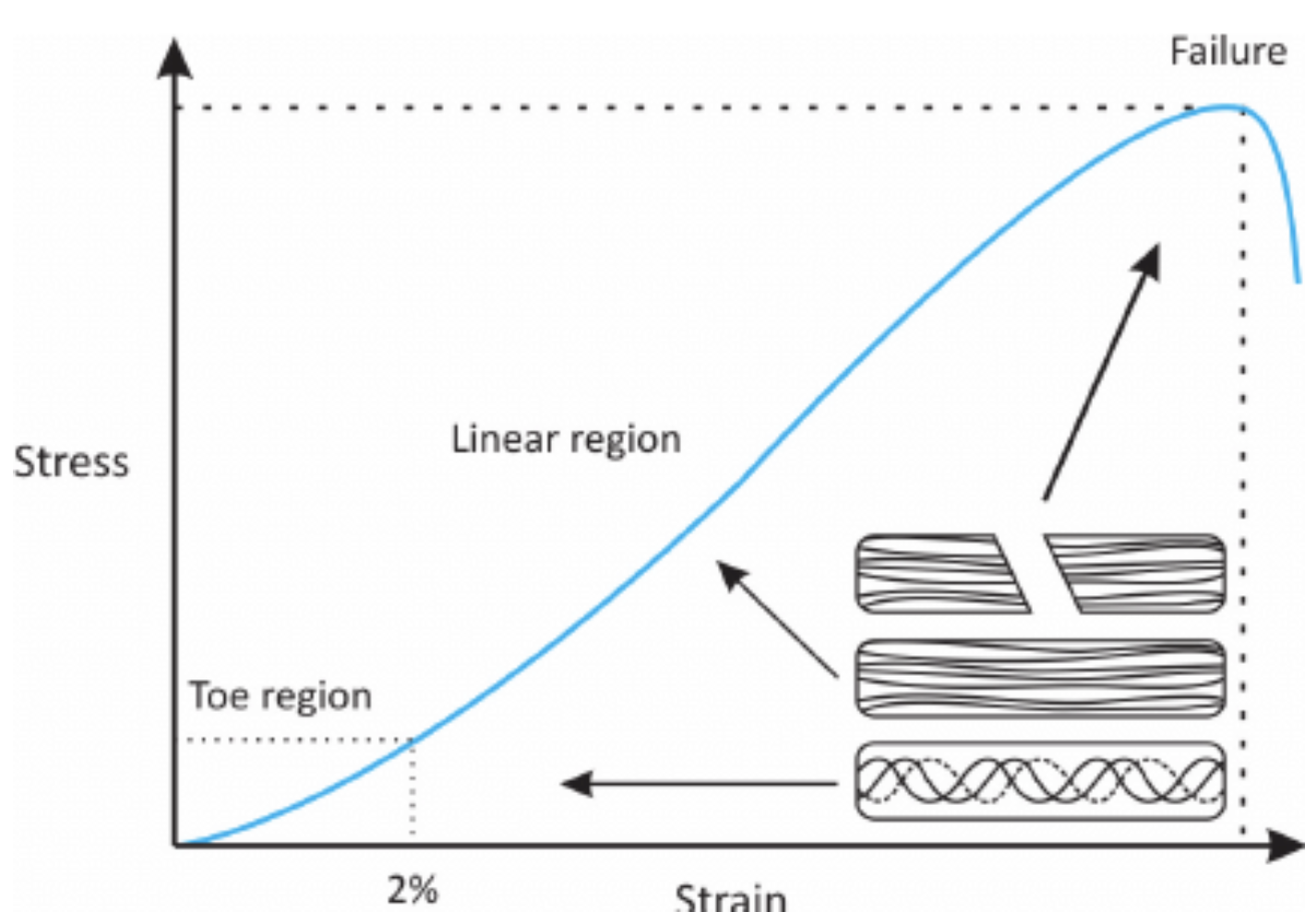
随着在更大应变值下刚度的增加,人体软组织经常展现出非线性的应力/应变曲线。组织的应力/应变曲线是从业者寻求改变和适应运动员的既定运动项目的需求的一个重要因素。组织的适应能力,表现为SAID原则(对提出要求的具体适应),并首先建立在Wolff和David定律的基础上,意味着所有的训练内容都会被这个曲线所主导,并且该曲线是被所有的训练适应所主导的。从力学角度而言,提出的要求似乎不易理解或利用;然而,它们是组织形成和运动表现的基础。因此,首要任务是阐明力学是如何控制身体的。
张拉整体(Tensegrity)
张拉整体是R Buckminster Fuller创造的术语:这个词来源于张力和整体的组合;它是指由张力和抗压缩元素组成的结构。与典型的建筑相比,张拉整体不需要持续的压缩;而需要通过持续的张力获得稳定和强度。抗压缩元素之间互不接触;而是漂浮在张力元素中。(3,34,81,85)通过这一点,整个结构作为一个单一的单元;张力的变化沿着结构辐射,改变其平衡并引起形变。只有通过高移动支持元素才能防止这种情况发生,因为它们使力得以局部消散并且保持平衡,而不是整体改变平衡和影响变化。(3,34)张拉整体创造了自我包含的单一单元结构,该结构存在于平衡状态,表现出柔韧性、低能耗和鲁棒性(Robust,健壮和强壮的意思),同时与其他结构方法相比,限制了质量。(49,50,73,78)
张拉整体理论已经开始从生物力学的角度进行研究,命名为生物张拉整体。生物张拉整体已经进行了从机体细胞到全身的不同层面的研究和应用。(35,50,73,82,90)其中整体层面拥有最显而易见且实用的应用。
关于人体作为张拉整体模型的理论,利用骨骼作为漂浮在产生张力筋膜中的抗压缩元素。(76)筋膜的解剖结构使其成为了主要张力调整元素的理想候选者:事实上,整个身体作为张拉整体模型的想法很大程度上源于筋膜研究。(9,12,50,76)筋膜是一个庞大的相互关联的组织,(94)包裹和/或连接皮肤、(1)肌肉、(17,70,80,87)器官、(44)骨骼(70)和神经,(94)散布全身。(44,67)它具有内在张力,(47,50)缓慢和长期的收缩能力,(74,75)并且高度受神经支配。(40,46,61)在该张拉整体模型的应用中,其他软组织是如何配合筋膜的,值得简要描述。
因为张拉整体结构达到了平衡,所以力的变化会在整个结构中辐射。人体能够通过肌纤维的收缩做到这一点。因此它是一个通过自有收缩纤维(肌肉)进行自我推动的张拉整体。与筋膜相比,肌肉是快速收缩和“高生力”组织,被包裹和连接在张紧的筋膜中。(17,70,80,87)这样的解剖结构让肌肉更多地被视为类似于骨骼这样的,漂浮在产生张力的筋膜中的抗压缩元素,在这里产生运动。
肌腱与筋膜有着非常密切的关系,很多研究将其归类为一种特殊形式的筋膜。(44,76 )它们的解剖结构大体上是一样的,区别主要在于纤维走向。这样的结构差异意味着肌腱在抵抗和传输沿着纤维路径的强力量方面是非常出色的。(54, 97)这使其得以很好地与骨骼连接并相互传递力量。
张拉整体模型创造了一种优雅且流动的身体模型,筋膜产生张力,其他元素漂浮和包裹其中。其他软组织执行专门职能,如运动(肌肉)或耐受强力量、连接、能量返回(肌腱)。但是,负责控制的基础机械力是张力;没有它,结构将没有完整性。
‘It is necessary to understand that this is not an argument against mobility or strain, but rather about bringing attention to the trade-offs and balancing that must be done’
“必须了解,这不是反对灵活性或者应变,而是提醒要将注意力放在必须要做的权衡和平衡上。”

张力(Tension):身体中负责控制的力
张拉整体作为一种人体结构理论,正在不断发展并获得了越来越多的支持。它对于运动表现训练的影响是分层次的;然而它们确实集中在姿势上,如何实现和如何保持。了解张力——它如何产生以及它有何影响——对于恰当地应用该模型和更好的理解灵活性形式的影响而言是至关重要的。
与上述所有力学术语一样,张力也是建立在应力/应变关系之上。张力是在拉伸时产生的;因此它是应变的子序列。应力/应变关系意味着增加的应变伴随着增加的应力;因此,张力与刚度有着密切联系。随着张力增加,刚度也会增加,就像弓的不同开弓磅数一样。当涉及到生物组织时,有一个额外的组织适应性成分。它们能够改变其材料和特性;这意味着应力/应变曲线可以被改变,改变实现既定应变所需的应力量。这会继而引起张力和刚度的改变。
这里有必要对组织适应和应力/应变曲线如何发生进行一个简要的概述,理解这一点对于充分了解被应用和应答的内容非常重要。关于肌腱的研究表明训练会引起更高的胶原蛋白合成和周转;(39,45,55,59)这是一种对由训练干预造成的“破坏”和要求产生的治愈和适应机制。正在发生的事情很大程度上是收缩细胞的功能。(21)这些细胞被统称为成纤维细胞,但也有组织特异的名称——例如,在肌腱中,它们被称为腱细胞。(79)这些细胞通过管理细胞外基质(ECM)来控制组织特性。(36)ECM是一种包围细胞,包围及渗透组织的蛋白质和组织基本模块的矩阵。(25,77,98)收缩细胞从这里提取所需的材料来修复受破坏的组织。(6,25,36,37)
成纤维细胞的作用至关重要,因为在对于“破坏”修复的机制中,它们迁移到“破坏”位置(22)并且开始沉积来自ECM的所需材料,(21,22,36,53,64,71)同时收缩并引起组织中的张力变化。张力的变化和应力/应变曲线的变化取决于训练干预带来的力学刺激。这些刺激会决定所遭受的“破坏”、(15,43,62,89)细胞反应、(19,22,30,63,66,68,91)ECM蛋白沉积及其结构。(10,25,26,38,77)
组织的特性和形式很大程度上取决于ECM。ECM本身与细胞网络发生交互关系,起到至关重要的中介作用。(5,19,25,33,42,86)二者都依赖于它们所收到的力学刺激。力学刺激是身体功能和特性的基础。(15,18,19,33,66,68)力学刺激决定成纤维细胞收缩的动作和力量以及沉积的ECM材料类型,二者形成系统张力。
这如何影响训练的注意事项很大程度上取决于运动的要求。体操运动员需要很大的运动范围,因此应变能力必须要高;但是,他们还需要刚度来承受将要经历的高峰值力量。因此,必须创造足够的应变能力去执行他们的运动,并且在那些边界内最大限度地提高刚度和张力。在举重运动中,如果深蹲幅度打破平行线,则会被视为效率低下,执行了不必要的额外工作。在这种情况下,以牺牲应变能力为代价来增加刚度将是合理的。
最后一个例子强调了灵活性、刚度和张力之间的冲突。三级跳运动员经历的峰值力量可以达到体重的15倍,(69)这对于跟腱提出了很高的要求。精英级别的跳远、跳高、三级跳以及撑杆跳运动员的数据表明,这些运动员起跳腿跟腱有更高的刚度、更短的长度恢复时间、更低的应变和伸长,以及更大的横截面积。(7,23)这相当于很多人所说的“紧”,并且主流观点认为这是一个损伤风险因素,而灵活性训练是必要的。这不能解释“紧”是对慢性应力的适应,因此它是有目的的。三级跳运动员经历的峰值力量必须在0.157s ± 0.009秒内施加;(69)系统的松弛和高服从性意味着力的表达时间会增加,总的适用力会减少。
必须了解,这不是反对灵活性或者变,而是提醒要将注意力放在必须要做的权衡和平衡上。以三级跳运动员为例,过度的刚度会造成能量返还较差,可以理解成类似于尝试发射炮弹或投篮那样。有一个平衡需要注意:这是通过深思熟虑和娴熟的力学刺激发现的——这很大程度上决定了组织的材料和特性。灵活性训练的引入改变了应力/应变曲线,使其向应变段移动;其应用必须有明确和有力的理由表明在这种情况下,高于典型的刚度值对于运动表现是有益处的。这是在个人案例中需要考虑的;三级跳运动员可以比体操运动员更强调刚度,因为这能更好地优化他们的跳跃能力。
‘The mediating effects that collagen crimp holds on mobility and range of movement provides a potent explanation for the well- documented effects of resistance training in increasing tissue stiffness’
“胶原蛋白抑制灵活性和动作范围的中介作用,为抗阻训练在增加组织刚度方面有据可查的效果提供了强有力的解释。”
张力中的灵活性问题
在将张力模型应用于增加应变能力的过程中时,张力和刚度与应变能力之间固有的并列位置意味着总要有所权衡。增加组织应变能力的力学机制涉及细胞反应、材料沉积,以及它们的结构和组织。
从材料沉积开始,这个过程的机制和细节尚不明确。但是,研究发现静态拉伸会刺激苯酸合成(弹性蛋白前体),而循环拉伸会导致弹性蛋白合成增加。在应力诱导的脉冲力影响下,胶原蛋白合成会增加。(29)更高的弹性蛋白含量允许更大的应变损坏,但会降低应力损坏和组织刚度。(10)胶原蛋白和弹性蛋白的比率对于既定组织的应力/应变曲线有很大的影响。(10)通过可用信息以及力学管理效果和SAID原则可以得出结论,较大的应变要求产生更高的弹性蛋白含量,并因此提高应变能力。高应力要求会增加胶原蛋白含量,并因此提高刚度和张力能力。
胶原蛋白在本次讨论中非常重要,它对于组织力学特性有非常重要的决定意义。(62,92)胶原蛋白很大程度上是一种非延展性材料,(5)其应变损坏(破坏)在10%-16%之间。(89,96)这与应变能力大约在200%-300%的弹性蛋白形成鲜明对比。(10)低应变和丰富的结缔组织使胶原蛋白成为全身应变能力的主要限制器。(42)胶原蛋白具有抑制作用,(17)应变在0%上下波动。当胶原蛋白和胶原蛋白主导的组织(如肌腱)被测量时,它们会拥有一个非线性应力/应变曲线,在由于抑制形成的较陡的斜率出现之前,在最初的低应力下会出现很大的应变。(62,89)抑制量决定了易变形范围在胶原纤维变直、真实变形发生、组织刚度变得非常高之前可能有多大。此时,在损坏发生之前,可能会有有限的应变。目前,控制抑制的机制相对未知,细胞功能被认为是关键的中介因素,此外还有ECM创造的更广泛的力学环境。(32,48)
尽管机制和细节尚未完全清楚,但是力学原则和一般训练适应是清楚的。研究表明抑制在老年人群中是降低的,并且与刚度增加有关。(27)随着观察到肌腱的应力/应变曲线,这至少允许得出某种结论。灵活性的增加一部分是由于胶原蛋白抑制的增加,因为胶原蛋白能够在真实变性发生及应变值接近极限之前拉伸地更长。这带来的效果就是更大的极限动作范围,但与抑制较少的组织相比,在给定范围内的刚度较低。
胶原蛋白抑制灵活性和动作范围的中介作用,为抗阻训练在增加组织刚度方面有据可查的效果提供了强有力的解释。(11,14, 31,55,56,57,65,72)
抑制的水平和效果本身会受到发生在ECM水平上的适应的影响。胶原蛋白纤维的刚度和纤维间基质的刚度之间的比率是抑制的重要决定因素。(32)这个比率取决于ECM沉积的材料。更具屈服性的材料(例如弹性蛋白)对于通过与胶原蛋白纤维相关的刚度降低所实现的强抑制是有利的。(28)在ECM中沉积的材料受到局部收缩细胞群、(6,20,33,37,51,57)它们与ECM和局部环境的关系,(84,83,88)以及施加的力学刺激的控制。(18,68)
然后,所有其他的组织适应一样,灵活性受到机械力刺激和细胞反应的控制,并且将会改变组织的结构、材料和特性。
实际应用
应力和应变力学刺激之间的平衡中介了从细胞到整个组织水平的适应,决定了组织的材料和特性。这反过会影响组织的应力/应变曲线、运动员的表现能力,以及他们接下来将要接受的力学刺激。机械力对于人体及其功能至关重要,而张力可以说是整个身体的控制力量。接下来必须要回答的首要问题就是,如何最好地创造张力?
肌腱研究着重倾向于认为它的生理特性很大程度上是与一般筋膜相同的,并且要确定训练的反应,需要利用大量的研究。Bohm等人(11)为开启讨论提供了一个很好的点。他们的结论是:“……高负荷强度比低强度更能有效诱导适应性反应,而这似乎与肌肉收缩类型无关。”
对于包括Bohm的文章在内文献的调查表明,多种方法用于规定负荷,包括1RM、RM和最大自主收缩 (MVC)。所有这些方法得出的一致性结论是,更高的强度通常能产生更好的结果,大于80%。但是,有一些研究发现当等长收缩保持10秒或更久,会得到70%MVC的有力结果。这相当于甚至是超越了很多以更高强度进行的研究。尽管这可能与Bohm的上述结论不一致,但这种情况的发生可能有一种并不直接与Bohm矛盾的解释。
Bohm的元分析中包括了 Fouré(24)和Malliaras(56)的研究。Malliaras发现影响结果的是负荷而不是收缩类型;Fouré的无负荷训练导致了低得多的结果,不管收缩类型如何。此外,Kubo(41)发现在向心训练中的刚度增加比离心训练更大。其中至关重要的负荷方法是,在每一个研究协议中采取相同的负荷。因为离心肌肉活动能比向心收缩承受更大的重量,这种负荷方法对于向心收缩组而言实际上是更大的强度效果。
Kubo的发现是理解结果异质性的关键,并能解释关于强度和肌肉活动类型效果的研究的明显冲突的结果。采取更高重复持续的研究发现70%的强度有更强的效果,并且Kubo发现相同重量的向心活动会引起更大的适应,这一点指出组织所做承受的机械功是决定因素。因此负荷是非必要的,并且肌肉活动类型也不重要;影响结果的是力学要求。更大机械功会造成更大的刚度、横截面积和杨氏模量。该文章的发现阐明了力学要求有多重要:这个结论由此而来,并且从这个角度看是合理的,并不令人惊讶。我们可以被视为我们的力学经历的总和,因为这决定了能够塑造我们的适应。
‘When deciding on what mobility modality to use, the main considerations are level of knowledge and understanding with a given intervention and the specificity desired and offered by it’
“在决定使用什么灵活性形式时,主要的考虑因素是对于给定干预的知识和理解水平,以及想要的和它能提供的特异性”
如何发展灵活性?
知道了力量训练会引起刚度增加及其对应变造成的不可避免的效果,接下来必须要回答的问题是如何发展灵活性。对于控制组织应变能力机制的了解,在这里是至关重要的,因为这些机制应该被利用而不是被对抗。传统的灵活性训练利用肌筋膜放松技术和被动拉伸来保持低力学要求并直接对抗由此引发的其他力学要求及适应。因此,需要高训练容量和频率来维持效果。
反之,建议使用传统和被动的灵活性方法,以使力量训练达到更大的动作范围。在基于力量训练的灵活性训练中,传统的灵活性训练变成了一种临时辅助工具,张力和刚度被内部构建至新的范围,并且应变的变化也被嵌入到更为持久和稳健的适应中。此外,用于增加应变的刺激现在得到了更高机械功的支持,提高了有效性和由此引发的适应。最后,它停止已经完成的工作,以提高应变能力,该能力会直接对抗力量训练的表现,并能更好地调整力学刺激并使得适应彼此更为互补。
在决定使用什么灵活性形式时,主要的考虑因素是对于给定干预的知识和理解水平,以及想要的和它能提供的特异性。举例来说,静态拉伸能影响相对较大的区域,而肌筋膜放松——尤其是用类似曲棍球之类的东西——会使所采用的刺激精确得多。教会运动员他们要寻找什么、那种感觉是什么样的,以及要做什么,而不是仅仅给他们自主权和独自解决问题的能力,但是也要保证你的时间和注意在大规模的训练课上,并使得任何规模的组都有实现的可能。我根据经验给出的推荐是,组间的每一个目标区域进行20-60秒的灵活性训练。这通常会创造足以被注意到的活动范围增加,并能保证训练课流程易于管理。但是,跟所有事情一样,反应是因人而异的,所以要留意,确保活动范围确实有所增加。
关于使用什么力量训练的选择首先要围绕生物张拉整体的概念来考虑。一项训练通过它所提供平衡张力的量而拥有这方面的价值。如果要对抗内旋,那么就选择一项外旋训练;如果要对抗屈曲,那么就选择伸展训练,以此类推。在选择训练之前,需要汇集对所有相关区域的了解。最简单的方法是像进行肌筋膜放松那样对这些区域施加压力。当张力不平衡时,组织会被迫从错误的位置开始工作。结果就是组织的索状感觉,也可伴随疼痛。这些是我找到的最好的指标,可以识别出代偿和出问题的位置。灵活性训练和力量训练都是被选择用于改变张力,灵活性训练减少张力,力量训练增加张力。张力是基础。
在决定灵活性训练是不是真的必要之前,运动员会需要先进行中立位评估,以确保姿势是正确的。如果这个方法解决了问题,那么它就是一个姿势问题,要做的就是增加相关区域的刚度。如果问题依然存在,那么就存在结构性的不足,需要增加组织应变能力。这就要配对使用力量和灵活性训练了(详见下文案例)。
案例一
运动员背景:运动员右肘偶尔有轻微的肌腱问题。他的运动背景是休闲举重,高频(平均一周6次),以奥林匹克举重为主。
图1.1:评估肘关节过度内旋的简便快捷的方式强调让运动员将手放在患肢的肘关节下方。然后患肢及掌心向上。一旦准备好,运动员要放松患肢。如果有过度的内旋张力,它会将手掌拽向地面(见图1.2)。

图1.2:如图所示,支撑内旋的张力完全压倒了支撑外旋的张力。所以手被拽向内侧并且手掌向地面旋转。运动员的背景对于发现造成问题的原因很重要;高频次高强度的奥林匹克举重。在完成任何一种从地面开始的提拉动作时,都会用到双手正锁握。这种双手正锁握要求肘关节内旋。

图1.3和图1.4:这里演示了灵活性训练方法。由于张力正在造成被要求区域的拉伸困难。这个区域进行滚动也不适用,因此最简单的办法是让教练或者运动员自己施压。尝试找到感觉最紧张的区域。随着局部张力的增加,感觉越来越像很粗的绷紧的电线。我通常采用的办法是施加一定水平的静态压力来引起不适/疼痛,但是不要阻止运动员放松目标区域。

图1.5和图1.6:这里用到的力量训练是引体向上;该动作对肘关节外旋的要求正好直接对抗过度内旋。除此之外还可以考虑采取手部外旋的哑铃弯举或者反握划船。再加上一个粗手柄可能会增加对前臂的力学要求,因而要考虑在稳定外旋张力时做出更大的反应。
案例二
运动员背景:15岁橄榄球运动员,效力于当地俱乐部。他表现出相当明显的圆肩,伴随其他部位的姿势代偿。

图2.1:为了使这个姿势存在,肩关节前后侧的张力一定会失衡。但是,张力会随着姿势的变化而相应地发展。上斜方肌往往会变得高度紧张,并且在进行肌筋膜放松的时候产生疼痛。肩胛骨周围和后侧也会变得相对固定。在努力恢复肩部位置时,检查两边肩膀在活动范围和姿势方面是否存在限制总是值得的。
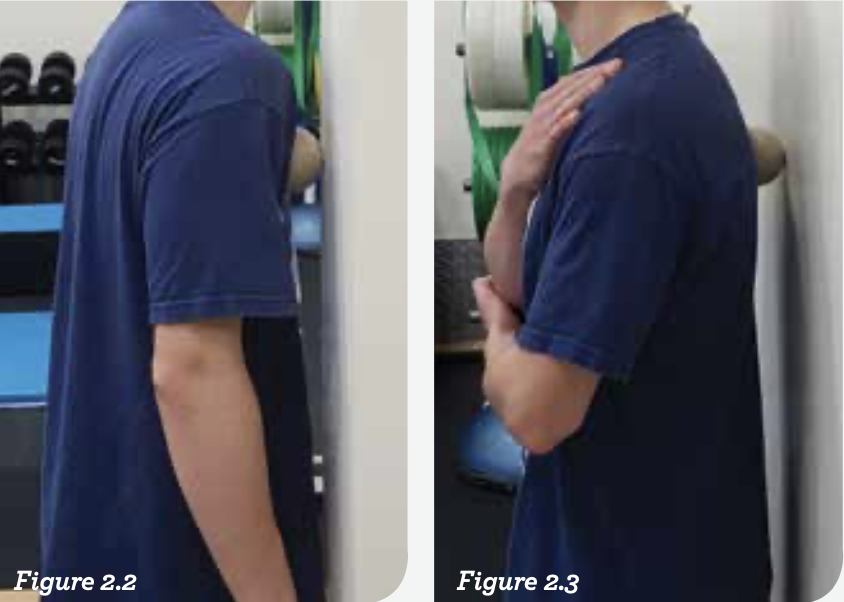
图2.2和图2.3:灵活性训练是为了尝试释放整个肩膀,确保训练姿势是最优的。这能提高产生张力的力量训练的有效性。识别出张力目前的位置很重要,因为这会指明灵活性训练和力量训练的方向。这个案例是典型的我经常遇到的情况:胸大肌高度紧张,尤其是与肩关节的连接点附近;上斜方肌高度紧张;菱形肌有些紧张。在有些案例中,最后一点会影响肩胛骨功能,并且是恢复姿势的主要元素。任务通常就是产生向后下方拉的张力,来抵消向前向上提升位置的张力。

图2.4-2.7:由于张力所在的位置,在这些训练中最好选择抓举,因为它能将负荷降到肩胛骨下方,并能创造一个较长的杠杆,使得肩膀必须通过增加机械负荷来对抗它以维持姿势。肩关节是一个复杂的关节,有很多训练的排列组合方式可以使用。我的经验和喜好是大重量的提拉运动,有时会利用暂停(演示训练是罗马尼亚硬拉,每次停顿5s)和过头推举,更喜欢从颈后位置开始。这些也是抓举的常见变式。这些训练有助于教会对方锁定肩胛骨:向后向下的姿势。
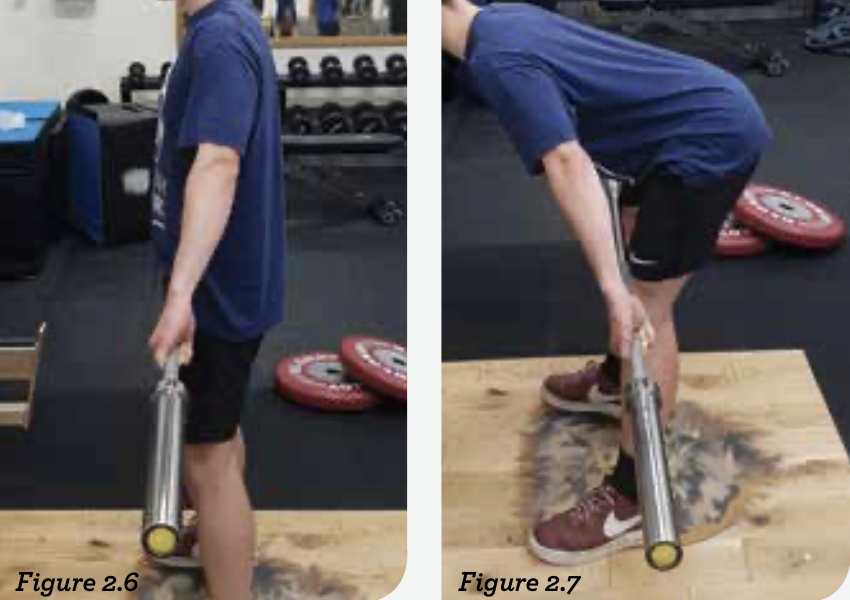
有时,通过伸展和收缩进行的训练是必要的,并且运动项目对于肩关节的要求也要考虑在内(伸展/收缩动作在投掷和球拍类项目中是非常重要的)。
案例三
运动员背景:18岁,十年以上俱乐部和游泳比赛经历。多年的高容量训练导致相当典型的游泳运动员姿态。此处的关注点在脚部姿势。“内八字”会影响髋关节功能,并引起举重动作姿势不到位的问题,特别是深蹲。这在走路的时候通常是最为明显的。
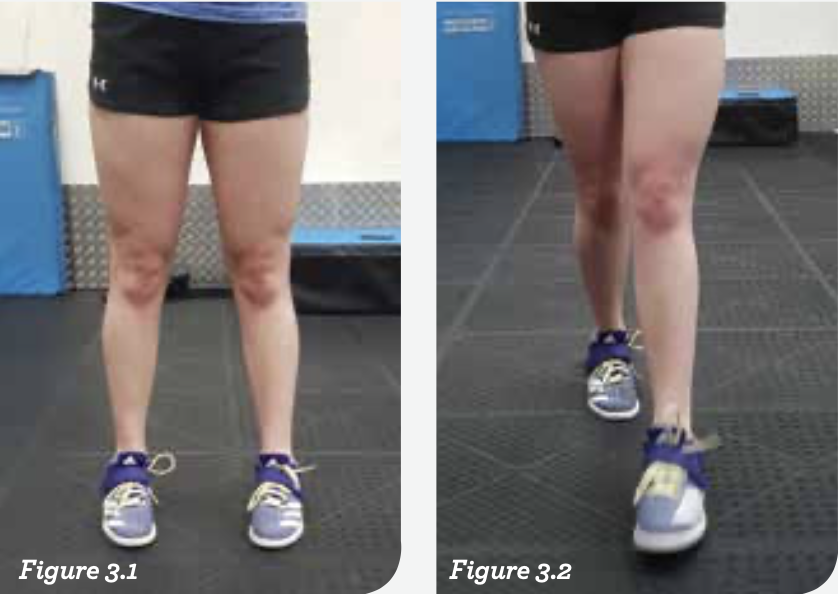
图3.1和3.2:这个姿势在髋关节前侧张力整体大于后侧的时候很常见。髋屈肌和股四头肌显得很紧,因为内旋负荷没有很好地通过臀部。相反,阔筋膜张肌,可能还有臀中肌,会变得高度紧张和疼痛。因此灵活性训练要针对这些区域。
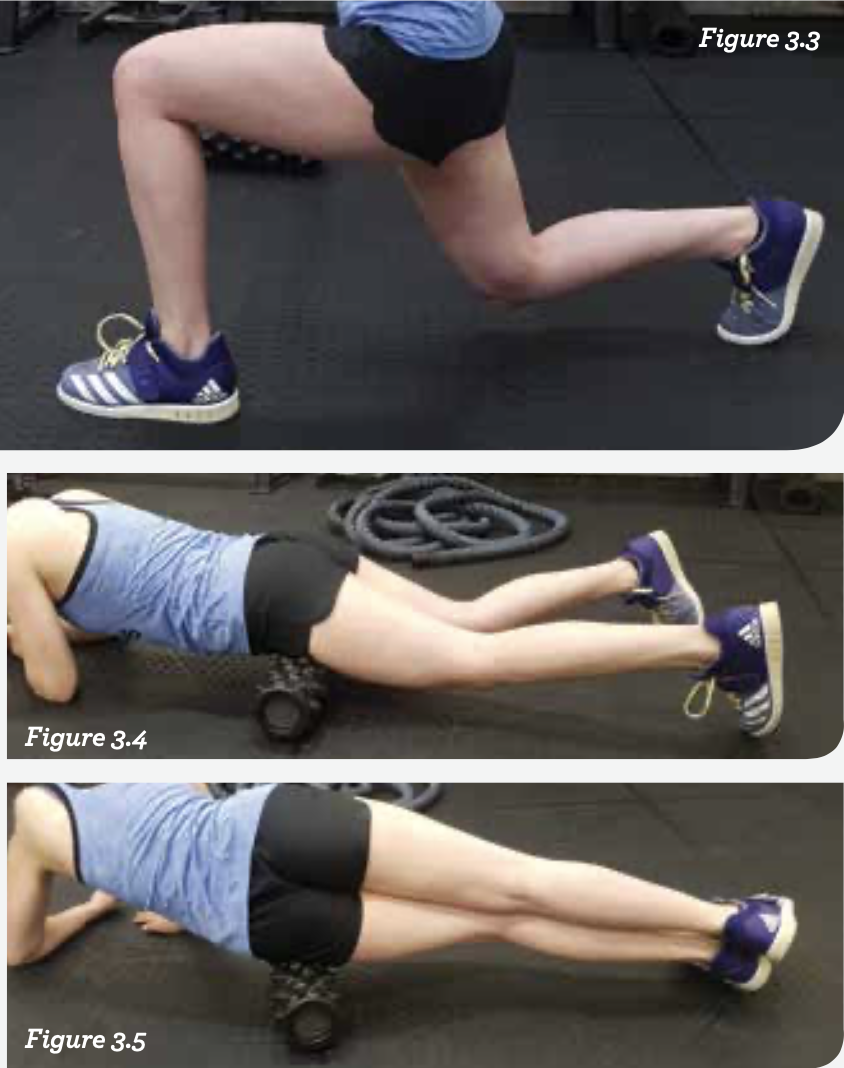
图3.3-3.5:纠正这个姿势需要通过一系列挑战目前限制的运动向髋屈肌和股四头肌施加负荷,从而使张力的变化根深蒂固。这还会要求臀部被正确施加负荷,消除使阔筋膜张肌紧张和可能造成臀中肌功能失调的负荷。
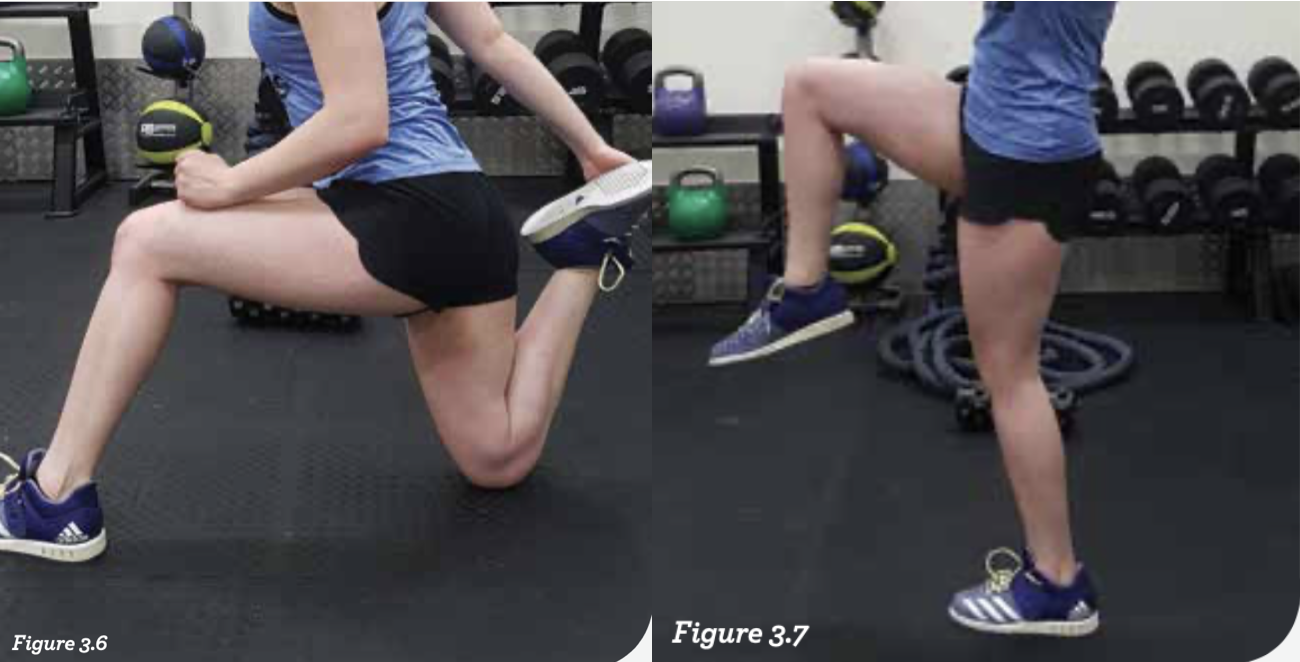
图3.6和3.7:弓步走——尽管不是满足以上所有要求的唯一选项——的确在这方面非常有效。这对于臀部肌群的要求很高,因为它们必须彻底控制很大的范围,并且在每一步的最高点要锁定髋部,使得它们在行走的过程中进入需要的姿势和适当的功能。后侧腿会拉伸髋屈肌和股四头肌,因此有助于重新产生紧张效应。
总结
灵活性对于达到更好的运动表现和减少损伤风险而言的重要性是清晰明确的;每一项运动都有不同的挑战和必要的动作,需要一定的灵活性水平。但是,灵活性作为一种训练工具的兴起,目前已经太过极端了:它被推崇为一种毫无代价的干预手段和治愈困扰运动员问题的良方。但是对于应力/应变曲线一端的极大化追求会造成另一端的极大代价。需要一个更为平衡的观点,将机械力的关键性考虑进去,包括它们如何相互作用,以及身体对于它们的反应。
凡事无绝对,作为运动员,他们的训练和损伤史,他们的运动项目和比赛风格,共同创造了独一无二的需求。只有对运动员进行评估,才能判断他们的需求。执行者的责任是了解这些变量并据此操纵运动员要承受的机械力。但是在所有的结果中,至关重要的都是张力及其与所施加的负荷之间的关系。正是这些力学因素真正决定了动作、姿势和灵活性。因此,即使在灵活性训练中,负荷和张力也是我们要考虑的首要原则。
关于灵活性的神话声称,在所有事情中,灵活性是解决伤病、疼痛、运动性功能失调和提高运动表现的途径的关键。但是,灵活性训练需要在合适的地方建立:它只是一种力学刺激。它的有效性依赖于在具体的任务中如何与其他机械力相融合,以及由此产生的适应。我们在某种程度上是我们的力学经历的总和,因此这必须加以保护和重视。
Source:Daniel S. Mobility training: debunking the myth. UKSCA Journal,(2019)54. Retrived from www.uksca.org.uk
参考文献:
1. Abu-Hijleh, M, Dharap, AS, Harris, PF. ‘Fascia superficialis’ In: Fascia: The tensional network of the human body. Schleip, R. Findley, TW. Chaitow, L. Huijing, PA. Eds. China: Elsevier, 2010. pp 19-23.
2. Alshomer, F, Chaves, C, Kalaskar, DM. Advances in tendon and ligament tissue engineering: materials perspective. Journal of Materials. https://doi. org/10.1155/2018/9868151. 2018.
3. Bansod, YD, Nandanwar, D, Bursa, J. Overview of tensegrity - I: Basic Structures. Engineering Mechanics. 21:355-367. 2014.
4. Bastos, CLB, Miranda, H, Vale, RGS, Portal, MN, Gomes, MT, Novaes, JS. Winchester, JB. Chronic effect of static stretching on strength performance and basal serum IGF-1 levels. Journal of Strength and Conditioning Research. 27:2465-2472. 2013.
5. Batzios, SP, Zafeiriou, DI, Papakonstantinou, E. Extracellular matrix components: an intricate network of possible biomarkers for lysosomal storage disorders. FEBS Letters. 587:1258-1267. 2013.
6. Baum, J, Duffy, HS. Fibroblasts and myofibroblasts: what are we talking about? Journal of Cardiovascular Pharmacology. 57:376-379. 2011.
7. Bayliss, AJ, Weatherholt, AM, Crandall, TT, Farmer, DL., McConnell, JC, Crossley, KM, Warden, SJ. Achilles tendon material properties are greater in the jump leg of jumping athletes. Journal of Musculoskeletal and Neuronal Interactions. 16:105-112. 2016.
8. Beardsley, C, Skarabot, J. Effects of self-myofascial release: a systematic review. Journal of Bodywork & Movement Therapies. http://dx.doi.org/10.1016/j. jbmt.2015.08.007. 2015.
9. Benjamin, M. The fascia of the limbs and back – a review. Journal of Anatomy. 214:1-18. 2009.
10. Black, LD, Allen, PG, Morris, SM, Stone, PJ, Suki, B. Mechanical and failure properties of extracellular matrix sheets as a function of structural protein composition. Biophysical Journal. 94:1916-1929. 2008.
11.Bohm, S, Mersmann, F, Arampatzis, A. Human tendon adaptation in response to mechanical loading: a systematic review and meta-analysis of exercise intervention studies on healthy adults. Sports Medicine-Open. 1:7. 2015.
12.Bordoni, B, Marelli, F, Morabito, B, Castagna, R, Sacconi, B, Mazzucco, P. New proposal to define the fascial system. Complementary Medicine Research. 25:257-262. 2018.
13. Bradbury-Squires, DJ, Noftall, JC, Sullivan, KM, Behm, DG, Power, KE, Button, DC. Roller-massager application to the quadriceps and knee-joint range of motion and neuromuscular efficiency during a lunge. Journal of Athletic Training. 50:133-140. 2015.
14. Brumitt, J, Cuddeford, T. Current concepts of muscle and tendon adaptation to strength and conditioning. The International Journal of Sports Physical Therapy. 10:748-759. 2015.
15. Burkholder, TJ. Mechanotransduction in muscle. Frontiers Bioscience. 12:174-191. 2007 skeletal
16. Butler, RJ, Crowell, HP, Davis, IM. Lower extremity stiffness: implications for performance and injury. Clinical Biomechanics. 18:511-517. 2003.
17. Cardinale, M, Newton, R, Nosaka, K. Strength and Conditioning: biological principles and practical applications. Chichester, Wiley-Blackwell, 2011. pp.4; 48-59.
18.Chen, CS. Mechanotransduction – a field pulling together? Journal of Cell Science. 121:3285-3292. 2008
19.Chiquet, M, Gelman, L, Lutz, R, Maier, S. From mechanotransduction to extracellular matrix gene expression in fibroblasts. Biochimica et Biophysica Acta. 1793:911-920. 2009.
20. de Jesús, A. Effects of mechanical stimulation on fibroblast-guided microstructural and compositional remodelling. University of Iowa. 2016.
21. des Jardins-Park, HE, Foster, DS, Longaker, MT. Fibroblasts and wound healing: an update. Regenerative Medicine. 13:491-495. 2018.
22. Eastwood, M, McGrouther, DA, Brown, RA. Fibroblast responses to mechanical forces. Proceedings of the Institution of Mechanical Engineers. 212:85-92. 1998. 23.
23.Epro, G, Konig, M, McCrum, C, Badorf, M, Schade, F, Karamanidis, K. Muscle-tendon adaptation monitoring in elite athletes: preliminary results from a longitudinal investigation. 35th Conference of the International Society of Biomechanics in Sports, Cologne, Germany, June 14-18, 2017.
24. Fouré A, Nordez, A, Cornu, C. Effects of eccentric training on mechanical properties of the plantar flexor muscle-tendon complex. Journal of Applied Physiology. 114:523-537. 2013.
25. Frantz, C, Stewart, KM, Weaver, VM. The extracellular matrix at a glance. Journal of Cell Science. 123:4195- 4200. 2010.
26.Freedman, BR, Bade, ND, Riggin, CN, Zhang, S, Haines, PG, Ong, KL, Janmey, PA. The (dys)functional extracellular matrix. Biochimica et Biophysica Acta. 1853:3153-3164. 2015.
27. Gogola, A, Jan, N, Brazile, B, Lam, P, Lathrop, KL,
Chan, KC, Sigal, IA. Spatial patterns and age-related changes of the collagen crimp in the human cornea and sclera. Investigative Ophthalmology & Visual Science. 59:2987-2998. 2018.
28. Gosline, J, Lillie, M, Carrington, E, Guerette, P, Ortlepp, C. Savage, K. Elastic proteins: biological roles and mechanical properties. Philosophical Transactions of the Royal Society B. 357:121-132. 2002.
29. Gupta, KV, Grande-Allen, J. Effects of static and cyclic loading in regulating extracellular matrix synthesis by cardiovascular cells. Cardiovascular Research. 72:375- 383. 2006.
30. Han B, Bai, X, Lodyga, M. Conversion of mechanical force into biochemical signalling. Journal of Biological Chemistry. 279:54793-54801. 2004.
31. Heinemeier, KM, Kjaer, M. In vivo investigation of tendon responses to mechanical loading. Journal of Musculoskeletal and Neuronal Interactions. 11:115-123. 2011.
32. Herchenhan, A, Kalson, NS, Holems, DF, Hill, P, Kadler, KE. Mergetts, L. Tenocyte contraction induces crimp formation in tendon-like tissue. Biomechanics and Modeling in Mechanobiology. 11:449-459. 2012.
33. Humphrey, JD, Dufresne, ER, Schwartz, MA. Mechanotransduction and extracellular matrix homeostasis. Nature Reviews Molecular Cell Biology. 15:802-812. 2014.
34. Ingber, DE, Heidemann, SR, Lamoureux, P, Buxbaum, RE. Opposing views on tensegrity as a structural framework for understanding cell mechanics. Journal of Applied Physiology. 89:1663-1678. 2000.
35. Ingber, DE. Tensegrity and Mechanotransduction. Journal of Bodywork and Movement Therapies. 12:198- 200. 2008.
36. Kendall, RT, Feghali-Bostwick, CA. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5:1-13. 2014.
37. Khaw, PT, Occleston, NL, Schultz, G, Grierson, I, Sherwood, MB, Larkin, G. Activation and suppression of the fibroblast function. Eye. 8:188-195. 1994.
38. Kjaer, M. Role of extracellular matrix in adaptation of tendon and skeletal muscle to mechanical loading. Physiological Reviews. 84:649-698. 2004.
39. Kjaer, M, Langberg, H, Heinemeier, K, Bayer, ML. From mechanical loading to collagen synthesis, structural changes and function in human tendon. Scandinavian Journal of Medicine & Science in Sports. 19:500-510. 2009.
40. Kopeinig, C, Gödl-Purrer, B, Salchinger, B. Fascia as a proprioceptive organ and its role in chronic pain – a review of current literature. Safety in Health. 1: http://www.safetyinhealth.com/content/1/S1/A2. 2015
41. Kubo, K, Yata, H. Effects of concentric and eccentric training on the stiffness and blood circulation of the patellar tendon. Sports Medicine International Open. 1: E43-E49. 2017.
42. Kular, JK, Basu, S, Sharma, RI. The extracellular matrix: structure, composition, age-related differences, tools for analysis and applications for tissue engineering. Journal of Tissue Engineering. 5:1-17. 2014.
43. Kumar, A, Chaudhry, I, Reid, MB, Boriek, AM. Distinct signalling pathways are activated in response to mechanical stress applied axially and transversely to skeletal muscle fibers. The Journal of Biological Chemistry. 277:46493-46503. 2002.
44. Kumka, M, Bonar, J. Fascia: a morphological description and classification system based on a literature review. The Journal of the Canadian Chiropractic Association. 56:179-191. 2012.
45. Langberg, H, Ellingsgaard, H, Madsen, T et al. Eccentric rehabilitation exercise increases peritendinous type I collagen synthesis in humans with Achilles tendinosis. Scandinavian Journal of Medicine & Science in Sports. 17:61-66. 2007.
46. Langevin, HM. Connective Tissue: a body-wide signalling network? Medical Hypothesis. 66:1074-1077. 2006.
47. Langevin, HM, Bouffard, NA, Fox, JR, et al. Fibroblast cytoskeletal remodelling contributes to connective tissue tension. Journal of Cell Physiology. 226:1166- 1175. 2011.
48. Lavagnino, M, Brooks, AE, Oslapas, AN, Gardner, KL, Arnoczky, SP. Crimp length decreases in lax tendons due to cytoskeletal tension, but is restored with tensional homeostasis. Journal of Orthopaedic Research. 35:573–579. 2017.
49. Levin, SM. ‘A different approach to the mechanics of the human pelvis: tensegrity’ In: Movement, Stability & Low Back Pain. Vleeming, A. Mooney, V. Snijders, CJ. Dorman, TA. Stoeckart, R. Eds. London: Churchill Livingstone 1997. pp.157-167.
50.Levin, SM, Martin, D-C. ‘Biotensegrity’ In: Fascia: The tensional network of the human body. Schleip, R. Findley, TW. Chaitow, L. Huijing, PA. Eds. China: Elsevier, 2012. pp 137-142.
51. Li, B, Wang, JH-C. Fibroblasts and myofibroblasts in wound healing: force generation and measurement. Journal of Tissue Viability. 20:108-120. 2011.
52. Macdonald, GZ, Penney, MDH, Mullaley, ME, et al. An acute bout of self-myofascial release increases range of motion without a subsequent decrease in muscle activation or force. National Strength and Conditioning Association. 27:812-821. 2013.
53. Mackenna, D, Summerour, SR, Villarreal, FJ. Role of mechanical factors in modulating cardiac fibroblast function and extracellular matrix synthesis. Cardiovascular Research. 46:257-263. 2000
54.Maganaris, CN, Paul, JP. In vivo human tendon mechanical properties. Journal of Physiology. 521:307- 313. 1999.
55. Magnusson, SP, Narici, MV, Maganaris, CN, Kjaer, M. Human tendon behaviour and adaptation, in vivo. Journal of Physiology. 586:71-81. 2008.
56.Malliaras, P, Kamal, B, Nowell, A et al. Patellar tendon adaptation in relation to load-intensity and contraction type. Journal of Biomechanics. 46:1893- 1899. 2013.
57. Massey, GJ, Balshaw, TG, Maden-Wilkinson, TM, Tillin, NA, Folland, JP. Tendinous tissue adaptation to explosive- vs. sustained-contraction strength training. Frontiers in Physiology. 9:1170. https://doi.org/10.3389/ fphys.2018.01170. 2018.
58. Meyer, ALM, Berger, E, Monteiro JO, et al. Quantative and qualitative analysis of collagen types in the fascia transversalis of inguinal hernia patients. Arquivos de Gastroenterologia. 44:230-234. 2007.
59. Miller, BF, Olesen, JL, Hansen, M et al. Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. Journal of Physiology. 567:1021-1033. 2005.
60. Miller, JK, Rockey, AM. Foam rollers show no increase in the flexibility of the hamstring muscle group. UW-L Journal of Undergraduate Research IX. 2006.
61. Myers, T. Fascial fitness: training in the neuromyofascial web. IDEA Fitness Journal. 8:1-11. 2011.
62. Nam, S, Hu, KH, Butte, MJ, Chaudhuri, O. Strain- enhanced stress relaxation impacts nonlinear elasticity in collagen gels. PNAS. 113:5492-5497. 2016.
63. Ng, JL, Kersh, ME, Kilbreath, S, Tate, MK. Establishing the basis for mechanobiology-based physical therapy protocols to potentiate cellular healing and tissue regeneration. Frontiers in Physiology. 8:303 doi: 10.3389/fphys.2017.00303. 2017.
64. Nilforoushzadeh, MA, Ashtiani, HRA, Jaffary, F et al. Dermal fibroblast cells: biology and function in skin regeneration. Journal of Skin and Stem Cell. 4: doi: 10.5812/jssc.69080. 2017.
65. Onambele-Pearson, G L, Pearson, SJ. The magnitude and character of resistance-training-induced increase in tendon stiffness at old age is gender specific. AGE. 34:427-438. 2012.
66. Orr, AW, Helmke, BP, Blackman, BR, Schwartz, MA. Mechanisms of mechanotransduction. Developmental Cell. 10:11-20. 2006.
67. Oschman, JL. ‘Fascia as a body-wide communication system’ In: Fascia: The tensional network of the human body. Schleip, R. Findley, TW. Chaitow, L. Huijing, PA. Eds. China: Elsevier, 2012. pp 103-110.
68.Paluch, EK, Nelson, CM, Biais, N, et al. Mechanotransduction: use the forces(s). BMC Biology. 13:47. 2015.
69. Perttunen, J, Kyrolainen, H, Komi, P, Heinonen, A. Biomechanical loading in the triple jump. Journal of Sports Sciences. 18:363-370. 2000.
70.Purslow, PP, Delage, JP. ‘General anatomy of the muscle fasciae’ In: Fascia: The tensional network of the human body. Schleip, R, Findley, TW, Chaitow, L, Huijing, PA. Eds. China: Elsevier, 2012. pp 5-10.
71. Ranzer, MJ, Chen, L, DiPietro, LA. Fibroblast function and wound breaking strength is impaired by acute ethanol intoxication. Alcoholism: Clinical and Experimental Research. 35:83-90. 2011.
72. Reeves, ND, Maganaris, CN, Narici, MV. Effect of strength training on human patella tendon mechanical properties of older individuals. Journal of Physiology. 584:971-981. 2003.
73.Scarr, G. Helical tensegrity as a structural mechanism in human anatomy. International Journal of Osteopathic Medicine. 14:24-32. 2011.
74.Schleip, R, Klingler, W, Lehmann-Horn, F. Active fascial contractility: fascia may be able to contract in a smooth muscle-like manner and thereby influence musculoskeletal dynamics. Medical Hypotheses. 65:273-277. 2005.
75. Schleip, R, Naylor, IL, Ursu, D, et al. Passive muscle stiffness may be influenced by active contractility of intramuscular connective tissue. Medical Hypotheses. 66:66-71. 2006.
76. Schleip, R, Jager, H, Klingler, W. What is ‘fascia’? A review of different nomenclatures. Journal of Bodywork & Movement Therapies. 16:496-502. 2012.
77. Screen, HRC, Berk, DE, Kadler, KE, Ramirez, F, Young, MF. Tendon functional extracellular matrix. Journal of Orthopaedic Research. 33:793-799. 2015.
78. Skelton, RE, Adhikari, R,Pinaud, JP, Chan, W. ‘An introduction to the mechanics of tensegrity structures’. Conference on Decision and Control. Orlando, Florida USA December 2001. 4254-4259.
79. Snedeker, JG, Foolen, J. Tendon injury and repair – a perspective on the basic mechanisms of tendon disease and future clinical therapy. Acta Biomaterialia. 63:18-36. 2017.
80.Stone, MH, Stone, M, Sands, WA. Principles and Practice of Resistance Training. Leeds, Human Kinetics, 2007. pp 18.
81. Swanson, RL. Biotensegrity: a unifying theory of biological architecture with applications to osteopathic practice, education, and research – a review and analysis. The Journal of the American OsteopathicAssociation.113:34-52.2013.
82. Tadeo, I, Berbegall, AP, Escudero, LM, Alvaro, T, Noguera, R. Biotensegrity of the extracellular matrix: physiology, dynamic mechanical balance, and implications in oncology and mechanotherapy. Frontiers in Oncology. 4:1-10. 2014.
83. Tate, MLK, Gunning, PW, Sansalone, V. Emergence of form from function – mechanical engineering approaches to probe the role of stem cell mechanoadaptation in sealing cell fate. BioArchitecture. 6:85-103. 2016.
84.Tee, S, Fu, J, Chen, C, Janmey, PA. Cell shape and substrate rigidity both regulate cell stiffness. Biophysical Journal. 100:L25-L27. 2011.
85. Tibert, AG. Pellegrino, S. Review of form-finding methods for tensegrity structures. International Journal of Space Structures. 18:209-223. 2003.
86. Tracy, LE, Minasian, RA Caterson, EJ. Extracellular matrix and dermal fibroblast function in the healing wound. Advances in Wound Care. 5:119-136. 2014.
87. Verkhoshansky, Y, Siff, MC. Supertraining. 6th ed. Verkhoshansky.com pp.35-36. 2009.
88. Vogel, V, Sheetz, M. Local force and geometry sensing regulate cell functions. Molecular Cell Biology. 7:265- 275. 2006.
89. Wang, JHC. Mechanobiology of tendon. Journal of Biomechanics. 39:1563-1582. 2006.
90. Wang, N, Naruse, K, Stamenovic, D, et al. Mechanical behaviour in living cells consistent with the tensegrity model. Proceedings of the National Academy of Sciences of the United States of America. 98:7765- 7770. 2001.
91. Wells, RG. Tissue mechanics and fibrosis. Biochimica et Biophysica Acta. 1832:884-890. 2013.
92. Wenger, MPE, Bozec, L, Horton, MA. Mesquida, P. Mechanical properties of collagen fibrils. Biophysical Journal. 93:1255-1263. 2007.
93. Weppler, CH, Magnusson, SP. Increasing muscle extensibility: a matter of increasing length or modifying sensation. Physical Therapy. 90:438-449. 2010.
94. Willard, FH. ‘Global organization of fascia in the body’ In: Fascia: The tensional network of the human body. Schleip, R. Findley, T, W. Chaitow, L. Huijing, P, A. Eds. China: Elsevier, 2000. pp 11-17.
95. Witvrouw, E, Mahieu, N, Danneels, L, McNair, P. Stretching and injury prevention. An obscure relationship. Sports Medicine. 34:443-449. 2004.
96. Wren, TAL, Yerby, SA, Beaupre, GS. Carter, DR. Mechanical properties of the human Achilles tendon. Clinical Biomechanics. 16:245-251. 2001.
97. Wren, TAL, Lindsey, DP, Beaupre, GS, Carter, DR. Effects of creep and cyclic loading on the mechanical properties and failure of human Achilles tendons. Annals of Biomedical Engineering. 31:710-717. 2003.
98. Yue, B. Biology of the extracellular matrix: an overview. Journal of Glaucoma. 23: S20-S23. 2014.
如果你有问题,请点击下方“问答”,寻求大家帮助,或咨询专家。




发表评论 取消回复